肝豆状核变性是由于先天性的铜代谢障碍所引起的一组全身性疾病,呈常染色体隐性遗传。
- 别名:
-
英文名:
gandouzhuanghebianxing
-
发病部位:
肝脏 脑
- 就诊科室:
-
症状:
怪异表情,舞蹈样动作,骨质疏松,角膜K-F环,肝铜量增加,血清铜氧化酶活性降低,CT头部双侧豆状核低密度灶,尿铜增加,血铜降低,血清转氨酶升高,血清铜蓝蛋白降低
-
多发人群:
儿童 青少年
-
治疗手段:
饮食治疗 药物治疗 对症治疗 手术治疗
- 并发疾病:
-
是否遗传:
是
-
是否传染:
否
疾病详情
概述肝豆状核变性 (hepatolenticular degeneration,HIJD)又称威尔逊病(Wilson disease,WD),是以铜代谢障碍为特征的常染色体隐性遗传病。由于WD基因(位于13q14.3)编码的蛋白(ATP7B酶)的突变,导致肝从胆汁排泄铜能力降低,造成肝铜含量增高和功能障碍,以及血循环的铜主要载体,血清铜蓝蛋白合成不足和循环中含量下降,血清游离铜增高,而出现肝外如脑、肾等多器官的铜沉积和功能障碍。WD是全球性疾病,世界范围的患病率约为30/10C万,我国的患病率及发病率高于欧美。
发病机制铜是人体的必需金属,是很多蛋白的重要辅酶。铜由食物提供,一般为2-5mg/d,推荐摄入量为0.9mg/d,多余的铜将被排除。铜由肠道细胞吸收,主要在十二指肠和近端小肠,铜联合白蛋白和组氨酸由门脉循环传递到肝,在此处铜多数从循环中被清除。肝利用一些铜为代谢所需,合成和分泌含铜蛋白,即血浆铜蓝蛋白(ceruloplasmin,CP)和排除过量的铜入胆汁。故任何损害胆汁排泄的情况都能导致肝铜的含量增加。
常染色体隐性遗传的铜代谢异常在WD的发病机制已确定。自1993年WD的异常基因被鉴定后,对其发病机制有了更确切认识。该基因为ATP7B,编码P型铜转运腺苷三磷酸酶(ATPase),该基因主要在肝细胞表达,具有在肝细胞内跨膜传导铜的功能。ATP7B蛋白的缺如或降低将导致肝细胞将铜排泄入胆汁的能力降低,结果造成铜在肝的积聚和肝的损害。最终,铜被释放入血,沉积在肝以外,如脑、肾、角膜等多种器官。功能性ATP7B蛋白的丧失导致CP的减少。CP是肝合成的蛋白质,是血循环中铜的主要携带者,约占正常人循环铜的90%。当CP减少时,循环中的游离铜相应增高,导致铜在肝外器官的沉积和功能障碍。
WD的自然史可分为如下四期:
第一期:铜集聚在肝结合部位的初始阶段。
第二期:肝的铜和由肝释放的循环中铜的急性再分布。
第三期:铜慢性集聚在脑和其他肝外组织,造成进行性和最终致命的多器官损害。神经WD即发生在此期。
第四期:长期应用螯合剂或肝移植再建铜的平衡。
WD是铜代谢障碍,初始于肝,后造成多器官铜沉积。各器官受累的早晚、病情轻重和进展各不一致,故病理表现也不尽相同,很难用一种病理改变概括。不过,在WD出现神经系统症状时,脑部病理表现以壳核最明显,其次为苍白球及尾状核,大脑皮质亦可受累。壳核最早发生变性,后病变范围逐渐扩大到上述诸结构。壳核萎缩,岛叶皮质内陷,壳核及尾状核色素沉着,严重者可形成空洞。镜检可见壳核内神经元和髓鞘纤维显著减少或完全消失,胶质细胞增生。其他受累部位镜下可见类似变化。当出现角膜色素环(Kayser-Fleischer ring,K-F环)时,角膜边缘后弹力层及内皮细胞质内,有棕黄色的细小铜颗粒沉积。
临床表现WD可在任何年龄出现症状,但大部分患者在5~35岁发病。
WD是以肝为首的多系统疾病,但各器官的损害程度,发病和进展快慢,以及哪个器官作为首发临床表现和伴随哪些其他器官损害均无固定形式。但其中以肝和神经系统病损造成临床症状最常见,以下简述常见器官损害的临床表现(表1)。
(1)肝症状:神经WD患者的肝受累程度和临床表现存在较大差异,部分患者表现为肝炎症状,如倦怠、乏力、食欲不振,或无症状的转氨酶持续增高;大多数患者表现为进行性肝大,继而进展为肝硬化,脾大,脾功能亢进,出现黄疸、腹水、食管静脉曲张及上消化道出血等;一些患儿表现为暴发性肝衰竭伴有肝铜释放入血而继发的Coomb试验阴性溶血性贫血也有不少患者并无肝大,甚至肝缩小。
(2)神经系统症状:可以是极轻微和间断出现多年,但也可发展极快,于数月内进展至完全丧失生活能力和残废。神经WD曾被分类为:①运动不能肌强直综合征:与PD相似;②假硬化:突出表现为震颤;③共济失调;④肌张力障碍综合征。但多数病例为几种异常并存,且其严重程度各异,故实际临床上很难予以分类。
震颤的特征是粗大、无规律的肢体近端的颤抖,有扑翼样表现。肌张力障碍可呈局限性节段性或极端严重,累及全身所有部分,导致严重挛缩。最普遍的运动障碍为累及颅区,临床表现为构音困难(可能是小脑或锥体外系统导致的失声)、流涎或口咽部肌张力障碍。面部呈苦笑面容、下颌张开、持续流涎、唇退缩是特征的临床表现。语言改变和流涎可以是最早的神经症状。震颤肌强直综合征(青少年帕金森综合征)病例应高度怀疑WD。

表1 常见器官损害的临床表现
因控制运动障碍和进行性肌张力障碍困难,患者出现卧床不起、不能照料自己的生活。最终患者严重残废,虽然清醒,但不能说话。但WD患者存有晚期肝疾病时,神经系统症状可被误认为是肝性脑病的症状。
(3)精神症状:最常见为注意力分散,导致学习成绩下降、失学。其余有:情感障碍,如暴躁、欣快、兴奋、淡漠、抑郁等;行为异常,如生活懒散、动作幼稚、偏执等,少数患者甚至自杀;还有幻觉、妄想等。极易被误诊为精神分裂症、躁狂抑郁症等精神病。
(4)眼部症状:具有诊断价值的是铜沉积于角膜后弹力层而形成的K-F环,呈黄棕或黄绿色,以角膜的上下缘最为明显,宽约1.3mm,严重时呈完整的环形。应行裂隙灯检查予以肯定和早期发现。7岁以下患儿此环少见。
(5)肾症状:肾功能损害主要表现为肾小管的重吸收障碍,出现血尿(或镜下血尿)、蛋白尿、肾性糖尿、氨基酸尿、磷酸盐尿、尿酸尿、高钙尿。部分患者还会发生肾钙质沉积症和肾小管性酸中毒。持续性氨基酸尿可见于无症状患者。
(6)血液系统症状:主要表现为急性溶血性贫血,推测可能与肝细胞破坏致铜离子大量释放入血液,引起红细胞破裂有关。还有继发于脾功能亢进所致的血小板、粒细胞、红细胞减少,以鼻、齿龈、皮下出血为临床表现。
(7)骨骼肌肉症状:2/3患者出现骨质疏松,还有较常见的是骨及软骨变性、关节畸形X形腿或O形腿、病理性骨折、肾性佝偻病等。少数患者发生肌肉症状,主要表现为肌无力肌痛、肌萎缩。
(8)其他病变:皮肤色素沉着、皮肤黝黑,以面部和四肢伸侧较为明显;鱼鳞癣、指甲变形。内分泌紊乱如葡萄糖耐量异常、甲状腺功能低下、月经异常、流产等。少数患者可发生急性心律失常。
从以上多器官的多种轻重不同的临床表现看来,WD是多器官受累的疾患。不是肝病科或神经科医生能单独全面认识和多方位处理的疾病,应多学科共同参与。
1.诊断WD推荐的常规检查(表2):
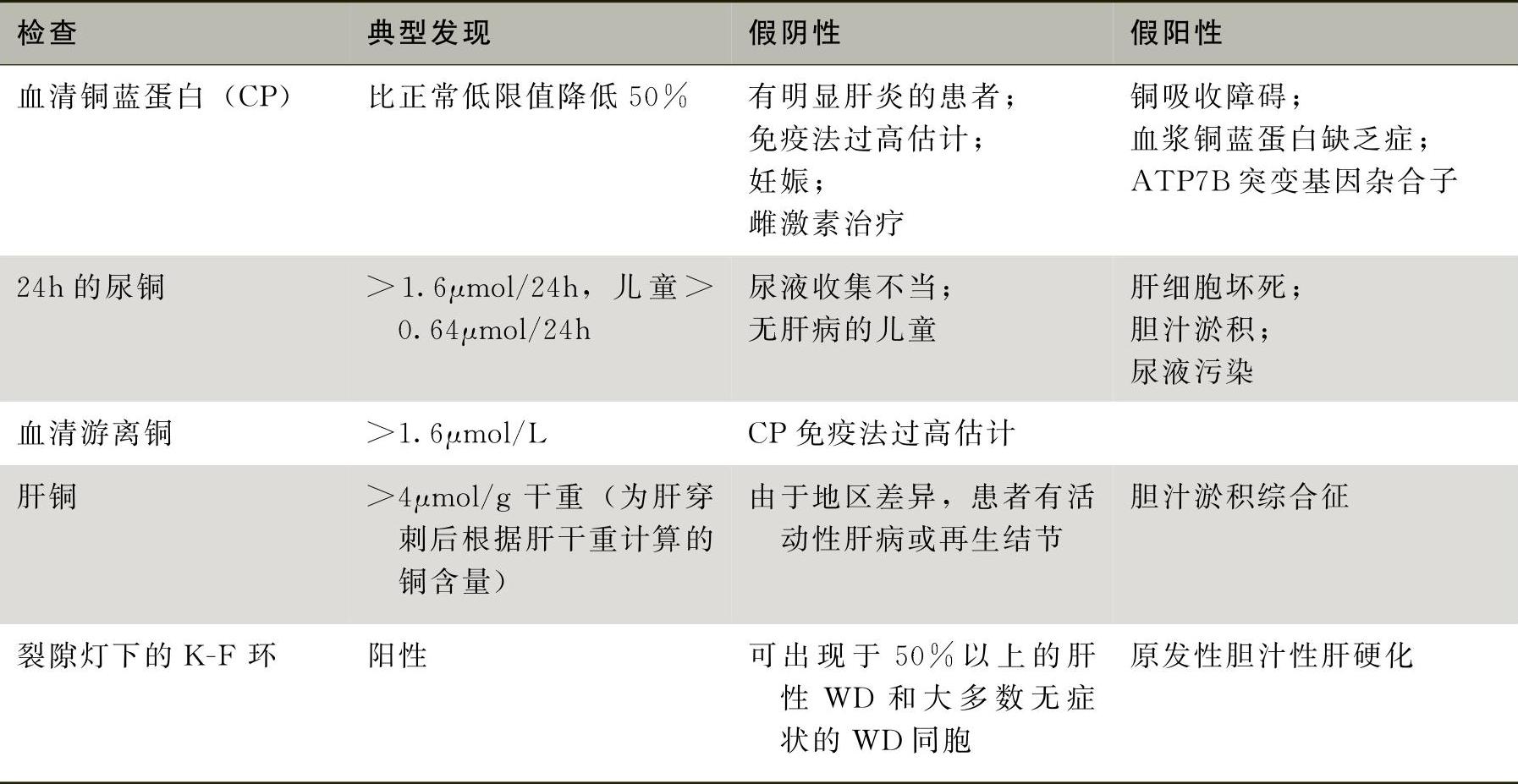
表2 WD诊断的常规检查
(1)角膜K-F环:须由有经验的眼科医生在裂隙灯下检查,确定角膜边缘后弹力层及内皮细胞质内,有棕黄色的细小铜颗粒沉积。
(2)实验室检查
1)血清铜蓝蛋白(CP):CP降低是诊断WD的重要依据之一。成人CP正常值为27~ 37mg/dl(270~370mg/L),新生儿的血清CP为成人的1/5,此后逐年增长,至3~6岁时达到成人水平。96%~98%WD患者CP降低,其中90%以上显著降低(0.08g/L以下),甚至为零。杂合子的CP值多在0.10~0.23g/L之间,但CP正常不能排除该病的诊断。
2)尿铜:尿铜增高也是诊断WD的重要依据之一。正常人每日尿铜排泄量为3~35μg/24h(0.047~0.55μmol/24h)。未经治疗的WD患者尿排铜量可略高于正常人甚至达正常人的数倍至数十倍,少数患者也可正常。
3)肝铜量:是诊断WD最重要的生化证据,但肝穿刺为有创性检查,目前尚不能作为常规的检测手段。
4)血清铜:正常成人血清铜为70~140μg/dl(11~22μmol/L),90%的WD患者血清铜降低,低于60μg/dl有诊断价值。须注意,肾病综合征、严重营养不良和失蛋白肠病也可出现血清铜降低。
2.影像学检查 颅脑CT多显示双侧对称的基底核区、丘脑密度减低,多伴有不同程度的脑萎缩。MRI多于基底核、丘脑、脑干等处出现长T1、长T2异常信号,约34%伴有轻至中度脑萎缩,神经WD患者CT及MRI的异常率显著高于以肝症状为主的WD患者。WD MRI特征性的发现“大熊猫脸征”,有诊断价值,但只见于少数患者。
3.基因诊断 虽然是金标准,但因WD的突变已有200余种,因此基因检测目前仍不能作为常规检测方法。
1.诊断
神经科见到的神经WD必需存有WD特有的神经症状(见上述神经系统症状)。虽多在5~35岁发病,但年龄不能作为诊断的限制。我国一般神经科不具备进行铜代谢详尽测定的手段和条件,故神经WD的诊断多依靠WD特有的神经症状、角膜K-F环、CP降低(<0.1g/L)和MRI特有表现进行诊断。当这些条件不能满足时,再进行铜代谢的其他检查。
2.鉴别诊断
本病临床表现复杂多样,鉴别应从肝及神经系统两个主要方面症状及体征考虑,须重点鉴别的疾病有急性和慢性肝炎、肝硬化、门克斯(Menkes)病、扭转痉挛、原发性肌张力障碍、PD舞蹈症和精神病等。Menkes病发病年龄更早,病变主要累及脑、毛发和皮肤,肝铜含量降低。
1.治疗目的
(1)排除积聚在体内组织过多的铜。
(2)减少铜的吸收,防止铜在体内再次积聚。
(3)对症治疗,减轻症状,减少畸形的发生。
2.治疗 基本原则是低铜饮食、用药物减少铜的吸收和增加铜的排出;治疗愈早愈好,对症状前期患者也需及早治疗。
(1)低铜饮食:尽量避免食用含铜多的食物,如坚果类、巧克力、豌豆、蚕豆、玉米、香菇贝壳类、螺类、蜜糖、各种动物肝和血等。此外,高氨基酸、高蛋白饮食能促进尿铜的排泄。
(2)阻止铜吸收:常用于治疗WD的药物见表3。
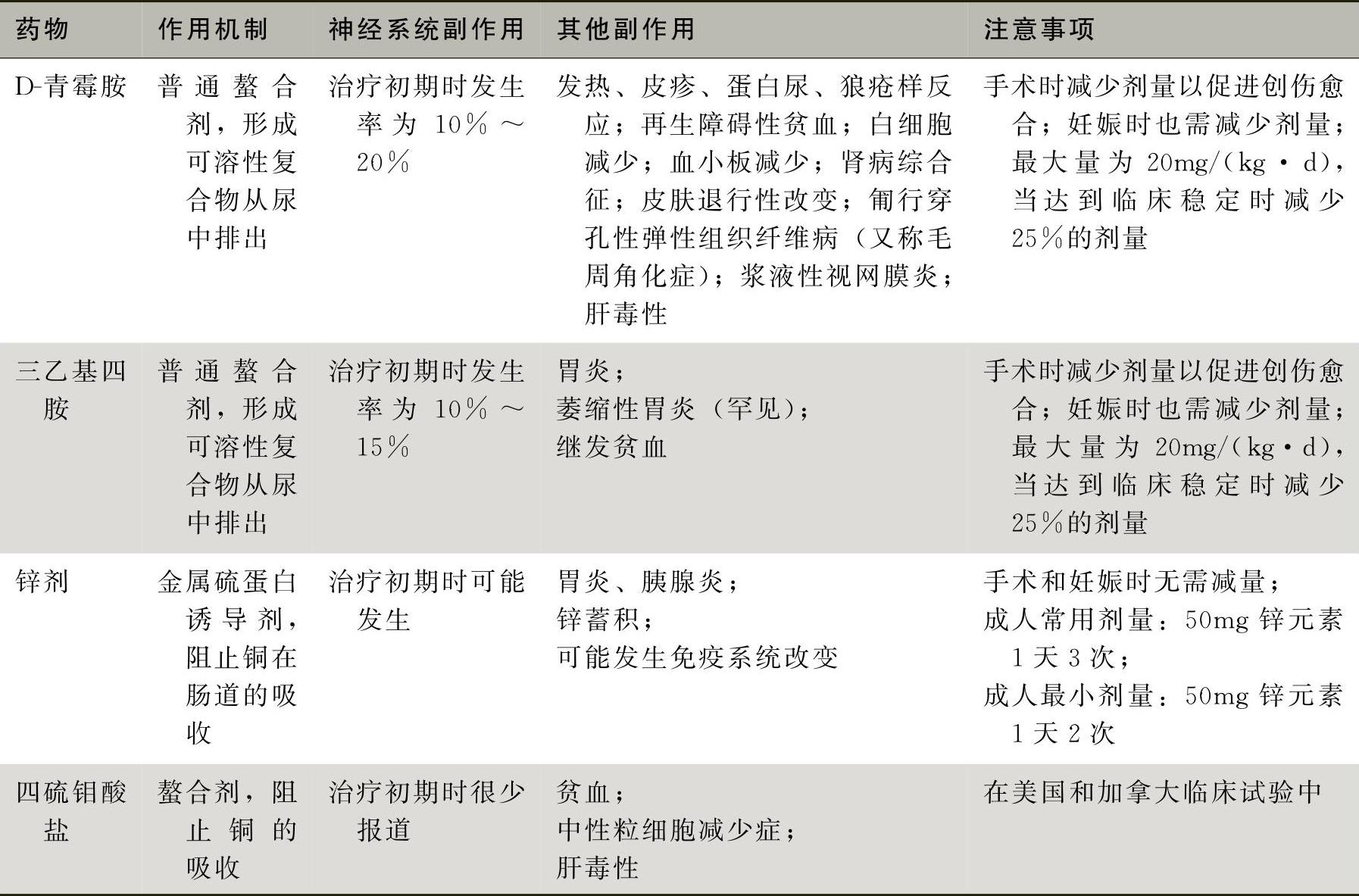
表3 治疗WD的常用药物
1)锌剂:通过竞争机制抑制铜在肠道吸收、促进粪铜排泄,尿铜排泄也有一定增加。锌剂能增加肠细胞与肝细胞合成金属硫蛋白而减弱游离铜的毒性。常用为硫酸锌200mg,3次/日;醋酸锌50mg,3次/日;葡萄糖酸锌70mg,3次/日;甘草锌等。不良反应轻,偶有恶心呕吐等消化道症状。
2)四硫钼酸铵(ammonium tetrathiomolybdate,TM):在肠黏膜中形成铜与白蛋白的复合物,后者不能被肠黏膜吸收而随粪便排出;另外能限制肠黏膜对铜的吸收,剂量20~60mg,每日6次,3次在就餐时服用,另外3次在两餐间服用。由于过量的钼可能滞留在肝、脾及骨髓内,故不能作为维持治疗。不良反应较少,主要是消化道症状。
(3)促进排铜:各种驱铜药物均为铜络合剂,通过与血液及组织中的铜形成无毒的复合物从尿排出。
1)D-青霉胺(D-penicillamine):是治疗WD的首选药物,药理作用不仅在于络合血液及组织中的过量游离铜从尿中排出,而且能与铜在肝中形成无毒的复合物而消除铜在游离状态下的毒性。动物实验还证明,青霉胺能诱导肝细胞合成金属铜硫蛋白(copper metallothionein),该硫蛋白也有去铜毒的作用。成人量1~1.5g/d,儿童为20mg/(kg·d),分3次口服,需终身用药。有时需数月方起效,可动态观察血清铜代谢指标及裂隙灯检查K-F环监测疗效。少数患者可引起发热、药疹、白细胞减少、肌无力、震颤,极少数可发生骨髓抑制、狼疮样综合征、肾病综合征等严重毒副作用。首次使用应行青霉素皮试,阴性才能使用。
2)三乙基四胺(triethyl tetramine):也是一种络合剂,其疗效和药理作用与D-青霉胺基本相同。成人用量为1.2g/d。不良反应小,可用于青霉胺出现毒性反应的患者。
3)二巯丁二钠(Na-DMS):是含有双巯基的低毒高效重金属络合剂,能与血中游离铜组织中已与酶系统结合的铜离子结合,形成解离及毒性低的硫酸化合物从尿排出。溶于10%葡萄糖液40ml中缓慢静注,每次1g,每日1~2次,5~7日为一疗程,可间断使用数个疗程不良反应较轻,牙龈出血和鼻出血较多,可有口臭、头痛、恶心、乏力和四肢酸痛等。
4)其他:如二巯丙醇(BAL)、二巯丙磺酸(DMPS)、依地酸钙钠(Edta Na-Ca)也可用于本病治疗,但现较少用。
(4)对症治疗:如有肌强直及震颤者用金刚烷胺和(或)苯海索,症状明显者可用复方左旋多巴;精神症状明显者应予抗精神病药;抑郁症状明显者可用抗抑郁药;智力减退者可用促智药。无论有无肝损害均需护肝治疗,可选用葡醛内酯(肝泰乐)、肌苷和维生素C等。
(5)手术治疗:包括脾切除和肝移植。对严重脾功能亢进患者因长期白细胞和血小板显著减少,经常出血、感染,又因青毒胺也有降低白细胞和血小板的不良反应,故患者不能用青霉胺或仅能用小剂量达不到疗效。对于此类患者,应行脾切除术。经各种治疗无效的严重病例可考虑肝移植。
本病早期诊断并早期驱铜治疗,一般较少影响生活质量和生存期,少数病情严重者预后不良。